Уравнение состояния. Давление в некоторой точке газа в заданном направлении определяется количеством движения, передаваемым в единицу времени в указанном направлении через единицу поверхности, перпендикулярную к этому направлению. В частном случае, когда газ находится около твердой стенки, это определение эквивалентно определению давления как силы, действующей на единицу поверхности. Но в кинетической теории газ должен рассматриваться как совокупность движущихся в пространстве частиц, и, следовательно, когда рассматриваются такие понятия, как давление одного газа на другой или градиент давлений, то применимо лишь первое определение.
Исходя из данного выше определения давления, легко показать, что давление однородного газа, находящегося в равновесии, выражается формулой

где vs = у v2 — средняя квадратичная скорость молекул и р — плотность газа. Очевидно,
Последнее соотношение выражает закон Бойля — Мариотта, так как в равновесном состоянии оба сомножителя правой части должны быть постоянны. Принцип равномерного распределения энергии по степеням свободы дает
где V — объем, занимаемый газом, и у — масса газа. Следовательно,
где Т — абсолютная температура, m — масса молекулы и к, равное 1,38-Ю-16 дин-см]град,— постоянная Больцмана. Тогда PV = kT-rfm. Если N — общее число молекул в объеме
то
— уравнение состояния однородного газа, находящегося в равновесии. Практически полезно принять 7? = к/m, после чего уравнение состояния будет иметь вид
но так как р = mN / V, то
Обычно в вакуумной практике Е — постоянно, а Р и N изменяются, поэтому здесь наиболее употребимым является уравнение состояния в виде (1.3).
Иногда желательно знать массу находящегося в сосуде газа. Из вышеприведенных соотношений следует, что
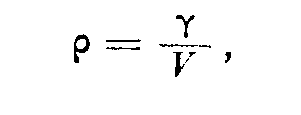
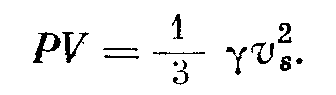

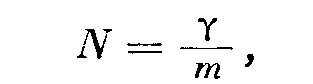
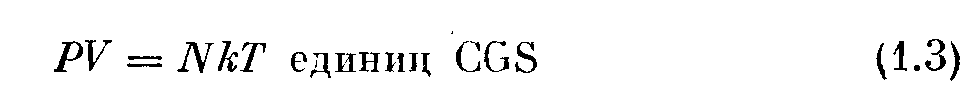
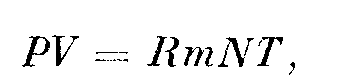
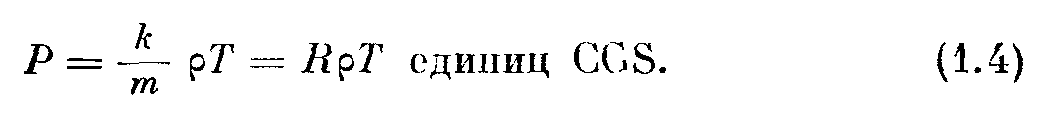
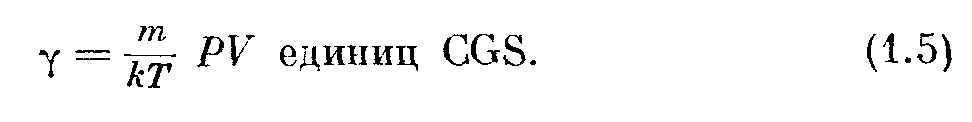
Уравнение (1.3) выведено, исходя из двух предположений, а именно: 1) молекулы имеют пренебрежимо малые размеры и 2) молекулы не взапмодействуют между собой, исключая моменты столкновений.
Рассмотрим теперь смесь нескольких газов, заполняющих объем V. Если Ni—полное число молекул г-го газа, то общее число молекул N = Рассматривая снова определение давления, разумно предположить, что если Р,— давление г-го газа, то общее давление Р = ЕР,-. Два оговоренных выше предположения позволяют считать, что каждый газ в отдельности подчиняется уравнению вида РД' = kN,Т. Отсюда следует, что уравнение (1.3) можно рассматривать либо как индивидуальное уравнение каждой компоненты в смеси, либо как уравнение суммы компонент смеси.
Оба предположения, использованные при выводе закона идеальных газов, в действительности не вполне справедливы для любого реального газа. Но справедливость этих условий возрастает по мере уменьшения давления, так что даже при умеренном вакууме газ с большой точностью подчиняется заковам идеальных газов.
Молекулярные скорости. Если любую молекулу газа как-лпбо отметить и наблюдать за ней, то мы заметим, что в течение каждой секунды она претерпевает большое число столкновений с другими молекулами. При каждом столкновении скорость любой молекулы изменяется, п, следовательно, как для одной молекулы, наблюдаемой в течение некоторого промежутка времени, так и для всех молекул, наблюдаемых в некоторый момент времени, можно говорить о «распределении скоростей» и о «средней скорости». Распределение скоростей определяется хорошо
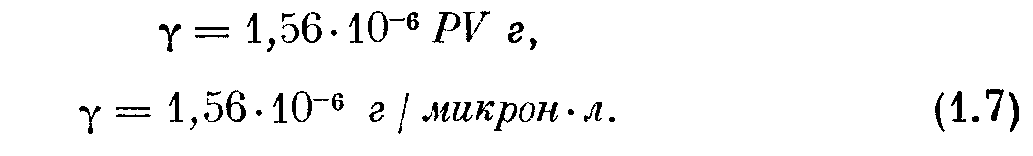
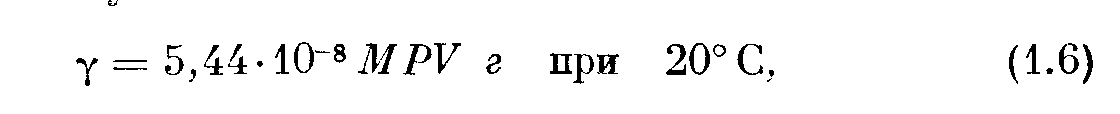
Для практического использования формулу (1.5) переводят в более удобные единицы. Взяв переводный множитель из приложения II, получим
где М — молекулярный вес газа, Р — давление в микронах ртутного столба и V — объем в литрах. Для данного рода газа масса пропорциональна произведению PV, и поэтому принято измерять количество газа в единицах PV, обычно в микрон-литрах; следовательно, масса воздуха, для которого М = 28,7, выразится в виде
известным законом распределения Максвелла, а именно: доля молекул, обладающих скоростями, заключенными в интервале от v до v 4- dv, пропорциональна
где р2 = т/2кТ, т — масса молекулы, к — постоянная Больцмана и Т — абсолютная температура. Это означает, что лишь небольшая часть молекул имеет очень большие или очень малые скорости. Большинство молекул имеют скорости, близкие по величине к средней скорости, определяемой соотношением
Попутно интересно отметить, что v приблизительно на 30% больше скорости звука и имеет ту же функциональную зависимость от Т и тп. Значения средней скорости v при 15° С для различных газов приведены в приложении III. Видно, что эти скорости велики — порядка 1 км/сек. Такие большие скорости хорошо используются в технике отыскания течей вакуумных систем.
Кинетической теорией также показывается, что в смеси газов каждый газ имеет независимое распределение скоростей — такое, какое он имел бы, находясь в отдельности. Следовательно, соотношение (1.9) может быть использовано для любого газа вне зависимости от присутствия других газов. Максвелловское распределение имеет относительно острый максимум. Легко показать, что 75% молекул имеют скорости, находящиеся в интервале между 1 — 3 —
-к- V и v. Этот факт вместе с рассматриваемыми далее явлениями Л А
означает, что функция распределения, имеющая фундаментальное значение в понимании кинетической теории газов, может не учитываться в обычных вакуумных расчетах.
Средняя длина свободного пути. Хотя молекулы движутся при комнатной температуре со скоростью порядка 1 км/сек, каждая молекула проходит лишь небольшое расстояние до столкновения с другой молекулой или стенкой сосуда. Среднее расстояние, проходимое молекулой между двумя столкновениями с другими молекулами газа или со стенкой, называется «средней длиной свободного пути». Если молекулы газа рассматривать как упругие шары, то простой расчет, основанный на сравнении площадей сечения одной молекулы с суммой площадей сечений всех молекул, находящихся в единице объема, приводит к следующей формуле для средней длины свободного пути молекул однородного газа:

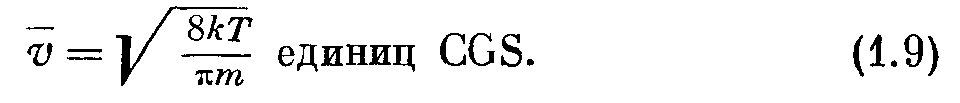
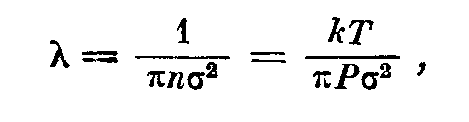

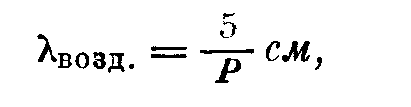
где к — постоянная Больцмана, Т — абсолютная температура, Р — давление в единицах CGS, п — число молекул в единице объема и <т — диаметр молекулы. В последнем выражении преобразование произведено на основании уравнения (1.3), так как
Если принять во внимание максвелловское распределение скоростей, то довольно длинные вычисления приведут к хорошо известному выражению для средней длины свободного пути:
В приложении III приведены значения средней длины свободного пути X для ряда газов при комнатной температуре и давлении в 1 р. Hg. Значения X при других давлениях или температурах получаются из очевидных соотношений. Очень удобно помнить, что средняя длина свободного пути для воздуха равна
где Р выражено в микронах ртутного столба. Так, при давлении Ю'6 мм Hg средняя длина свободного пути равна 50 м, что значительно больше размеров любой обычной вакуумной аппаратуры.
Очевидно, что при очень низких давлениях большинство столкновений происходит со стенками сосуда, в котором находится газ, а не с другими молекулами. Таким образом, среднее расстояние между столкновениями не равно X, а является просто средним размером сосуда. Это может привести к предположению, что распределение скоростей молекул при очень низких давлениях изменяется. Однако температура газа, находящегося в равновесии, не может отличаться от температуры стенок. Основываясь на этом, можно доказать, что распределение скоростей и средняя скорость не меняются и при низких давлениях.
Выражение (1.10) применимо к однородному газу. Обычно имеют дело со смесями газов, например с воздухом. Если в (1.10) величина <т является средним значением диаметра молекулы для смеси газов, то это выражение определяет среднее значение X, чем и пользуются для получения средней длины свободного пути в воздухе. Можно получить общее выражение для средней длины свободного пути каждого рода молекул в смеси, но оно не является необходимым в дальнейшем изложении. Однако следующий специальный случай представляет практический интерес.
Рассмотрим два газа, молекулярные веса которых Мг и М2 , и парциальные давления Рг и Р2. В кинетической теории
показано, что
Очевидно, что в случае ст1= ст2 и Мх= М2 это выражение сводится к (1.10).
Для иллюстрации этого уравнения рассмотрим смесь малого количества гелия с воздухом при низком давлении. Из приложения III имеем
Таким образом, средняя длина свободного пути молекул небольшой примеси гелия к воздуху в два с лишним раза больше средней
к
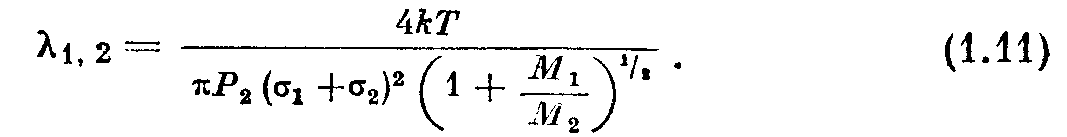
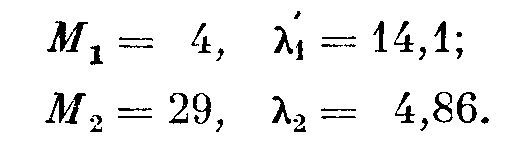
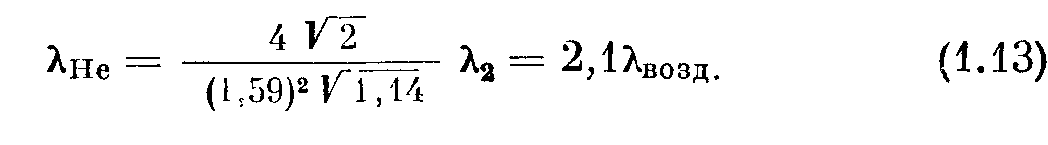
Следовательно,
длины свободного пути молекул воздуха, при условии, что давление еще настолько велико, что средняя длина свободного пути молекул воздуха меньше размеров сосуда.
Из уравнения (1.12) можно получить среднюю длину свободного пути электронов в газе.

